Вопрос о том, что легче вступает в реакцию с металлом, – это фундаментальный аспект химии, определяемый множеством факторов․ Активность различных веществ по отношению к металлам зависит от их электроотрицательности, потенциала восстановления и способности образовывать устойчивые химические связи․ В общем случае, более электроотрицательные элементы и соединения с высоким окислительным потенциалом демонстрируют большую реакционную способность․ Но точный ответ на вопрос «что легче вступает в реакцию с металлом» требует конкретизации рассматриваемых веществ и условий проведения реакции․
Факторы, влияющие на реакционную способность
Реакция металла с другим веществом – это сложный процесс, который подвержен влиянию множества факторов․ Рассмотрим основные:
- Электроотрицательность: Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны и тем легче он будет реагировать с металлом, отнимая у него электроны․
- Потенциал восстановления: Вещества с высоким потенциалом восстановления (то есть те, которые легко принимают электроны) более активно вступают в реакции окисления-восстановления с металлами․
- Условия реакции: Температура, давление, наличие катализаторов и растворителя могут существенно влиять на скорость и ход реакции․
Сравнение реакционной способности различных веществ
Некоторые вещества демонстрируют более высокую реакционную способность по отношению к металлам, чем другие․ Приведем примеры:
Кислород
Кислород – один из самых распространенных и активных окислителей․ Многие металлы легко реагируют с кислородом, образуя оксиды․ Например, железо ржавеет во влажном воздухе, образуя оксид железа (ржавчину)․
Галогены
Галогены (фтор, хлор, бром, йод) – это очень электроотрицательные элементы, которые активно реагируют с металлами, образуя соли․ Фтор, как самый электроотрицательный галоген, обладает наибольшей реакционной способностью․
Кислоты
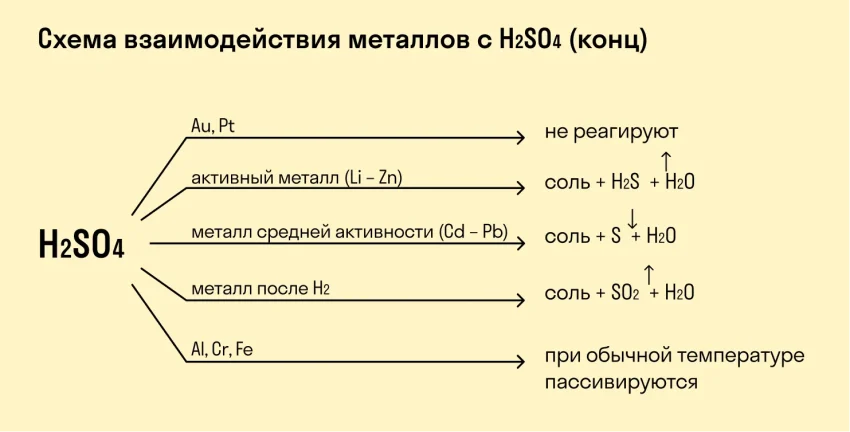
Кислоты, особенно сильные (например, соляная и серная), реагируют с многими металлами, выделяя водород и образуя соли․ Скорость реакции зависит от активности металла и концентрации кислоты․
Сравнительная таблица реакционной способности
| Вещество | Реакционная способность с металлами | Примеры реакций |
|---|---|---|
| Кислород | Высокая (особенно при высоких температурах) | 2Mg + O2 → 2MgO (горение магния) |
| Фтор | Очень высокая | 2Na + F2 → 2NaF |
| Хлор | Высокая | Fe + Cl2 → FeCl3 |
| Соляная кислота (HCl) | Средняя (зависит от активности металла) | Zn + 2HCl → ZnCl2 + H2 |
ЧТО ЛЕГЧЕ ВСТУПАЕТ В РЕАКЦИЮ С МЕТАЛЛОМ?
Вопрос о том, что легче вступает в реакцию с металлом, – это фундаментальный аспект химии, определяемый множеством факторов․ Активность различных веществ по отношению к металлам зависит от их электроотрицательности, потенциала восстановления и способности образовывать устойчивые химические связи․ В общем случае, более электроотрицательные элементы и соединения с высоким окислительным потенциалом демонстрируют большую реакционную способность․ Но точный ответ на вопрос «что легче вступает в реакцию с металлом» требует конкретизации рассматриваемых веществ и условий проведения реакции․
ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ
Реакция металла с другим веществом – это сложный процесс, который подвержен влиянию множества факторов․ Рассмотрим основные:
– Электроотрицательность: Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны и тем легче он будет реагировать с металлом, отнимая у него электроны․
– Потенциал восстановления: Вещества с высоким потенциалом восстановления (то есть те, которые легко принимают электроны) более активно вступают в реакции окисления-восстановления с металлами․
– Условия реакции: Температура, давление, наличие катализаторов и растворителя могут существенно влиять на скорость и ход реакции․
СРАВНЕНИЕ РЕАКЦИОННОЙ СПОСОБНОСТИ РАЗЛИЧНЫХ ВЕЩЕСТВ
Некоторые вещества демонстрируют более высокую реакционную способность по отношению к металлам, чем другие․ Приведем примеры:
КИСЛОРОД
Кислород – один из самых распространенных и активных окислителей․ Многие металлы легко реагируют с кислородом, образуя оксиды․ Например, железо ржавеет во влажном воздухе, образуя оксид железа (ржавчину)․
ГАЛОГЕНЫ
Галогены (фтор, хлор, бром, йод) – это очень электроотрицательные элементы, которые активно реагируют с металлами, образуя соли․ Фтор, как самый электроотрицательный галоген, обладает наибольшей реакционной способностью․
КИСЛОТЫ
Кислоты, особенно сильные (например, соляная и серная), реагируют с многими металлами, выделяя водород и образуя соли․ Скорость реакции зависит от активности металла и концентрации кислоты․
СРАВНИТЕЛЬНАЯ ТАБЛИЦА РЕАКЦИОННОЙ СПОСОБНОСТИ
Вещество
Реакционная способность с металлами
Примеры реакций
Кислород
Высокая (особенно при высоких температурах)
2Mg + O2 → 2MgO (горение магния)
Фтор
Очень высокая
2Na + F2 → 2NaF
Хлор
Высокая
Fe + Cl2 → FeCl3
Соляная кислота (HCl)
Средняя (зависит от активности металла)
Zn + 2HCl → ZnCl2 + H2
ФАКТОРЫ, ЗАМЕДЛЯЮЩИЕ ИЛИ ПРЕДОТВРАЩАЮЩИЕ РЕАКЦИИ
Важно понимать, что не все реакции металлов с веществами протекают спонтанно и быстро․ Существуют факторы, которые могут замедлять или даже полностью предотвращать химическое взаимодействие․ К ним относятся:
– Пассивация: Некоторые металлы (например, алюминий и хром) образуют на своей поверхности тонкую, но прочную оксидную пленку, которая препятствует дальнейшей коррозии․ Этот процесс называется пассивацией․
– Отсутствие контакта: Для реакции необходимо обеспечить хороший контакт между металлом и реагентом․ Если между ними находится инертная среда или защитный слой, реакция будет затруднена․
– Низкая температура: Как правило, повышение температуры увеличивает скорость химических реакций․ При низких температурах даже активные вещества могут реагировать очень медленно․
– Ингибиторы: Некоторые вещества, называемые ингибиторами, могут замедлять или предотвращать коррозию металлов․ Они часто используются для защиты металлических конструкций и оборудования․
ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЗНАНИЙ О РЕАКЦИОННОЙ СПОСОБНОСТИ МЕТАЛЛОВ
Знание того, что легче вступает в реакцию с металлом, имеет огромное значение в различных областях, таких как:
– Производство материалов: При выборе материалов для конструкций, работающих в агрессивных средах, необходимо учитывать их устойчивость к коррозии․
– Химическая промышленность: Контроль реакционной способности металлов необходим для проведения многих химических процессов․
– Электрохимия: Понимание реакций металлов лежит в основе работы аккумуляторов и гальванических элементов․
– Охрана окружающей среды: Знание процессов коррозии металлов помогает разрабатывать методы защиты от загрязнения окружающей среды․